La chimie appliquée à l'aquariophilie
Le cycle de l'azote
Présentation schématique
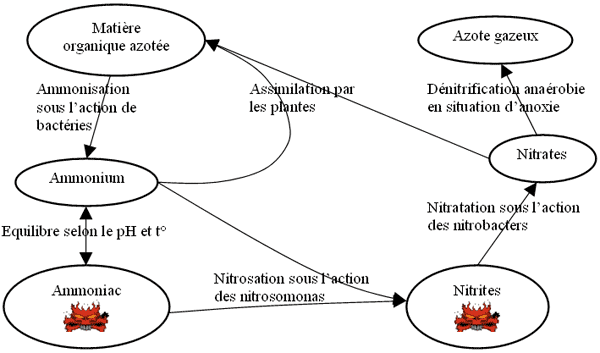
L'ammonisation
Les déchets produits dans l'aquarium (déjections des poissons, décomposition des excès de nourriture, feuilles mortes, ...) comportent de nombreuses matières organiques azotées :
- la fonction amine -NH2 appartenant aux acides aminés constitutifs des protéines
qui est transformée en ammonium sous l'action de bactéries :
acides aminés + eau => ammonium
R-NH2 + H2O => NH4+ + ...
- l'urée qui elle aussi est transformée en ammonium sous l'action de bactéries :
urée + eau => ammonium + ion carbonate
CO(NH2)2 + 2H2O => 2NH4+ + CO32-
L'ammonium est une substance nutritive importante pour les plantes et n'est pas toxique pour les poissons à des teneurs raisonnables. La réglementation française a statué sur un seuil maximum de 4mg/l d'ammonium dans l'eau potable. Malheureusement, selon le pH, l'ion d'ammonium NH4+ peut se transformer en ammoniac NH3 bien plus toxique pour les poissons. La teneur en ammoniac ne doit pas être supérieure à 0,25mg/l.
- ammonium + base OH- <=> ammoniac + eau
NH4+ + OH- <=> NH3 + H2O
Tableau donnant le pourcentage de NH3 par rapport à NH4+ dans une solution aqueuse à diverses valeurs de PH et températures :
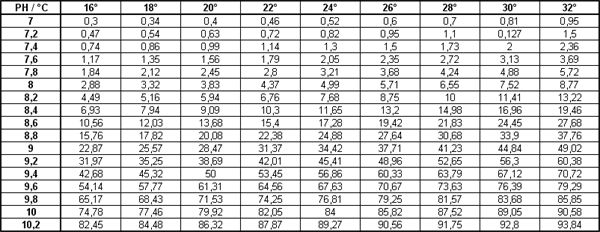
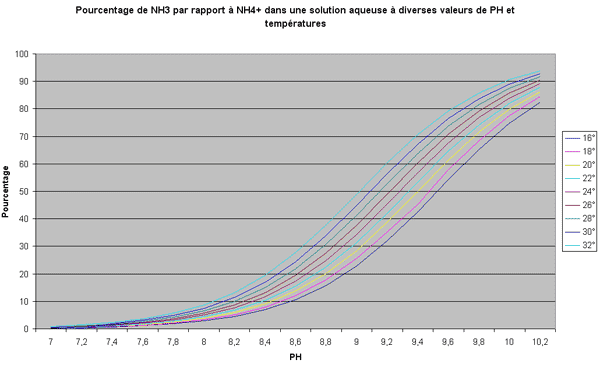
Les tests JBL permettent de mesurer la concentration d'ammonium et ammoniac réunis, le tableau précédent permet pour un pH et une température donnés d'en déduire le pourcentage d'ammoniac.
La nitrification
La nitrification est la transformation des composés azotés en nitrates. La réaction se décompose en deux étapes : la nitritation ou nitrosation (oxydation de l'ammonium et ammoniac en nitrites) et la nitratation (oxydation des nitrites en nitrates).
- nitritation sous l'action des bactéries autotrophes nitrosomonas :
ammonium + oxygène => nitrites + ions H+ + eau
2NH4+ + 3O2 => 2NO2- + 4H+ + 2H2O
ammoniac + oxygène + ions H+ + électrons => nitrites + ions H+ + électrons
NH3 + O2 + 2H+ + 2e- => NH2OH + H2O => NO2-+ 4H+ + 4e- - nitratation sous l'action des bactéries autotrophes nitrobacter :
nitrites + oxygène => nitrates
2NO2- + O2 => 2NO3-
Le pH optimal pour la nitrification se situe autour de 8. Les valeurs hors de l'intervalle 6.8 à 8.6 peuvent affecter l'efficacité de la nitrification. La température optimale pour les nitrosomonas se situe entre 30° et 36°. La température optimale pour les nitrobacters est de 28°.
Le nitrite est un puissant poison qui bloque le transport de l'oxygène dans le sang et provoque une asphyxie interne. La teneur en nitrite ne doit idéalement pas être supérieure à 0,1mg/l et en aucun cas dépasser 0,5mg/l.
Le nitrate ralentit la croissance des poissons et favorise le développement des algues indésirables. La teneur en nitrate ne doit pas dépasser 50mg/l.
La dénitrification
La dénitrification est définie comme étant le réduction des nitrates en azote gazeux avec pour intermédiaire le nitrite, l'oxyde nitrique et l'oxyde nitreux, chacun étant réduit par une enzyme réductase secrétée par des bactéries anaérobies (comme bacillus dénitrificans) :
- NO3- + nitrate réductase -> NO2- + nitrite réductase -> NO + oxyde nitrique réductase -> N2O + oxyde nitreux réductase -> N2
En aquarium, en eau douce comme en eau de mer, on cherchera à favoriser cette dénitrification hétérotrophe qui exige une source de phosphore et une source organique de carbone qui peut être du méthanol, du glucose ou tout simplement les déchets organiques du milieu. La dénitrification est une respiration particulière, c'est une alternative à la respiration classique de l'oxygène dans les zones peu oxygénées de l'aquarium. Il faudra donc essayer d'isoler les bactéries concernées dans un milieu anoxique pour favoriser la réduction des nitrates, dans le cas contraire les bactéries préfèreront respirer avec l'oxygène. Voici quelques équations finales :
-
nitrates + éthanol => azote gazeux + eau + dioxide de carbone + ions OH-
26NO3- + 12(C2H5OH) => 13N2 + 30H2O + 24CO2 + 12OH-
nitrates + méthanol => azote gazeux + eau + dioxide de carbone + ions OH-
6NO3- + 5CH3OH => 3N2 + 7H2O + 5CO2 + 6OH-
nitrates + glucose => azote gazeux + eau + dioxide de carbone
4NO3- + C6H12O6 => 2N2 + 6H2O + 6CO2 + 4e-
Assimilation par les plantes
Les plantes contribuent au cycle en assimilant les nitrates et l'ammonium. Le pH semble avoir une grande importance : un abaissement du pH favorise l'absorption et l'assimilation des nitrates alors qu'une élévation de pH favorise celles des ions ammonium. Cela tient essentiellement au fait que l'absorption de NO3- s'effectue par contretransport avec OH- ou cotransport H+ alors que celle de NH4+ se fait par contretransport avec H+.
-
alimentation en ammonium et baisse du pH
ammonium => ammoniac + ion H+
NH4+ => NH3 + H+ -
réduction des nitrates par un gain de 8e- et hausse du pH
nitrates + ion H+ + électrons => ammoniac + eau + ion OH-
NO3- + 8H+ + 8e- => NH3 + 2H2O + OH-
Il est important de noter lors de la réduction des nitrates que NH3 n'est pas forcément libre mais éventuellement sous forme substituée R-NH2. Pour effectuer cette réduction, la plante synthétise de la nitrate réductase qui est une flavoprotéine contenant du fer et du molybdène.
Bibliographie
- Le cycle de l'azote
- Acides aminés ou aminoacides
- Nitrogenous Compounds in Water
- Le cycle de l'azote
- L'élimination de l'ammonium dans l'eau potable
- JBL - Solutions pour l'ammonium NH4
- JBL - Solutions pour le nitrite
- JBL - Solutions pour le nitrate
- La dénitrification
- Caractéristiques générales des deux étapes de la dépollution azotée : la nitrification et la dénitricication. Article de la société Biodigest
- L'épuration biologique en aquarium
- Physiologie végétale - tome 1 - nutrition - 6 ième édition - René Heller