Chimie : impact d'un réacteur à hydroxyde de calcium dans un aquarium récifal
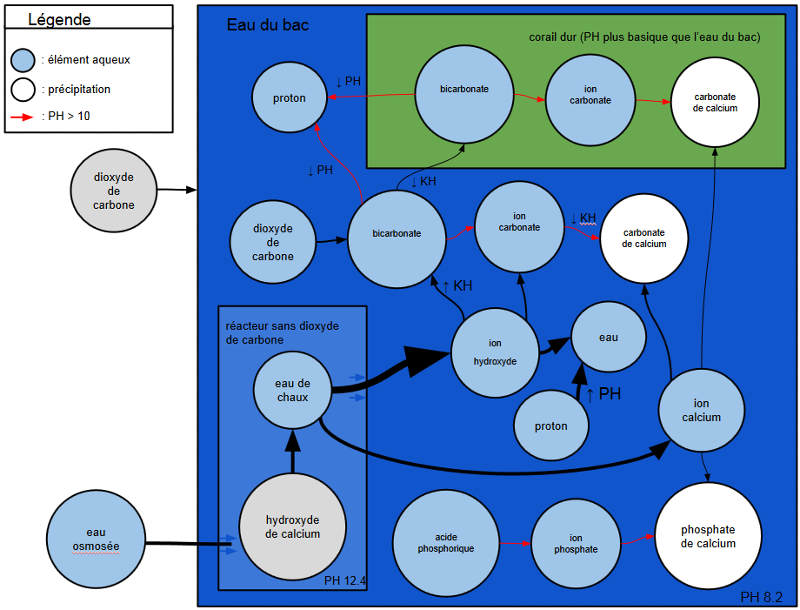
A l'intérieur du réacteur : fabrication de l'ion calcium en absence de dioxyde de carbone aqueux
On peut parler de quasi absence de dioxyde de carbone aqueux au vue de la faible quantité d'eau osmosée qui arrive dans le réacteur.
Par ailleurs, le réacteur étant hermétique, il n'y a pas de surface d'échange avec l'air permettant l'apport de dioxyde de carbone.
Arrivée d'eau par le bas avec fabrication de lait de chaux par agitation
Il s'agit d'une eau de chaux très concentrée avec des particules d'hydroxyde de calcium en suspension qui la rendent opaque.
Sortie de l'eau de chaux surnageant en partie supérieure
Dans l'eau du bac
Avec un PH normal inférieur à 10 : calcification dans les coraux durs dont le PH est plus élevé
Fabrication du bicarbonate
Absorption des ions calcium et bicarbonate dans le corps calcifiant des coraux durs
Avec un PH très basique supérieur à 10 : précipitations
Ce cas peut survenir lors d'une injection d'une quantité trop importante d'eau de chaux ou d'un mauvais brassage avec l'eau du bac ...
Formation de carbonate de calcium (chute du KH)
Le carbone existe sous plusieurs formes selon les quatre équilibres suivant :
Plus le PH est basique et plus l'équilibre tend vers la droite, c'est à dire la précipitation en carbonate de calcium.
Cette précipitation est accompagnée de la création de protons lesquels vont faire baisser le PH (pH = -log([H+]) : c’est l’effet tampon du bicarbonate.
De même, plus le PH est acide et plus l'équilibre tend vers la gauche avec l'absorption des protons et la hausse du PH.
Dolomite par formation de carbonate de magnésium se fixant sur du carbonate de calcium (chute du KH)
Phosphates de calcium
Le phosphate existe sous quatre formes selon le taux d'acidité. Voici les trois équilibres du plus acide au plus basique :
Lorsque le PH dépasse 10 ce qui peut arriver avec l'injection d'eau de chaux, il y apparition de l'ion phosphate et différentes formules peuvent amener à sa précipitation :
Références
Le réacteur à hydroxyde de calcium (RAH)
Du bon usage de l’eau de chaux et du réacteur à hydroxyde
Les phosphates
Calcification des coraux scléractiniaires - Du polype aux molécules
Précipitation - Produit de solubilité
Produit de solubilité de la calcite
Chimie des eaux
Le Magnésium dans les aquariums récifaux.
